1.
2.
3.
El blog de Oliver
Tarea de la escuela Rodolfo Walsh
jueves, 14 de diciembre de 2017
viernes, 1 de diciembre de 2017
viernes, 17 de noviembre de 2017
jueves, 26 de octubre de 2017
Pochoclera
Grupo conformado por:
Valentin Oliver
Matias Kazandjian
Juan Manuel Romero
Pablo Perez
Primera Tanda:
Segunda Tanda:

jueves, 12 de octubre de 2017
jueves, 7 de septiembre de 2017
experimento bolitas de hidrogel
Primer frasco: solucion de agua con sal
Segundo frasco: agua destilada
Tercer frasco: agua
¿Qué le ocurriría a una célula en cada una de las condiciones anteriormente mencionadas?
La membrana semipermeable del glóbulo dejaría pasar o transcurrir un movimiento de agua hacía el interior del mismo, provocando que se hinche y seguidamente reviente o estalle.
En el caso de una solución hipertónica el agua dentro del globulo rojo sale para alcanzar el equilibrio, produciendo un encogimiento del mismo (plasmolisis). Al perder agua la célula también pierden su habilidad para funcionar.
En el caso de una solución isotónica, la concentración en ambos lados de la membrana es igual, el agua se moverá hacia adentro y hacia afuera, a la misma velocidad, los glóbulos rojos mantienen su forma.
- Isotónica – b) Hipertónica – C) Hipotónica
miércoles, 30 de agosto de 2017
miércoles, 23 de agosto de 2017
miércoles, 2 de agosto de 2017
miércoles, 12 de julio de 2017
Curvas de Solubilidad
Interpretando curvas de
solubilidad Modelo 1 Tabla 1 Datos de la solubilidad
Temperatura
(ºC)
|
g
de soluto cada 100 g de agua (l)
|
10
|
33
|
30
|
42
|
50
|
52
|
70
|
62
|
90
|
73
|
Tarea
Completa el modelo: usando el diagrama haz
un gráfico de la solubilidad con los datos de la Tabla 1.
• Marca
el eje “x”, el eje “y” y crea una escala apropiada para cada uno.
• Marca
los puntos usando un lápiz.
1. ¿Cuál
es la información que nos brinda la Tabla 1?
2. ¿Cuál
es la relación entre la temperatura y la solubilidad para este soluto?
3. ¿Qué
pasará con este soluto cuando se agreguen 12 g a 100 g de agua a una
temperatura de 20ºC?
4. ¿Qué
tipo de solución se formará cuando se agreguen 12 g de soluto a 100 g de agua a
20ºC de temperatura (diluida, saturada o sobresaturada)?
5. A
20ºC, ¿cuál es la cantidad máxima de soluto que puede ser disuelta en 100 g de
agua?
6. ¿Qué
tipo de solución se forma cuando el máximo de soluto es disuelto en agua
(diluida, saturada o sobresaturada)?
7. A
20ºC, 50 g de soluto se agregan a 100 g de agua. ¿Qué pasará con el soluto extra?
8. ¿Qué
tipo de solución se forma en las condiciones de la pregunta 7 (diluida,
saturada o sobresaturada)?
Solubilidad Adaptado y traducido de POGIL 2005 by E. Graham
and R. McGrath – Prof. Cecilia Ferrante
Ejercicio
Usa la Tabla G
para contestar las siguientes preguntas
1. Compara
el gráfico que realizaste usando la Tabla 1 con el gráfico de la Tabla G. ¿Cuál de los solutos de la Tabla G es el
soluto de tu gráfico?
2. Identifica
la sustancia de la Tabla G que es más soluble a 60ºC.
3. Identifica
la sustancia de la Tabla G que es menos soluble a 60ºC.
4. Identifica
y establece la diferencia entre las curvas de solubilidad del amoníaco (NH3)
y el nitrato de sodio (NaNO3).
Noten que el amoníaco es un gas y el nitrato de sodio es un sólido a
temperatura ambiente.
5. Usa
la dependencia de la temperatura con la solubilidad para identificar cuales de
las sustancias de la Tabla G son gases y cuales son sólidas. Realiza dos listas, una para gases y otra
para sólidos.
6. Sugiere
una razón por la cual la solubilidad decrece con el aumento de la temperatura
para solutos gaseosos pero se incrementa para solutos sólidos.
Problemas
1. Todos
los días Pedro va al Café Havanna de Av. Gral. Mosconi y Artigas, pide un café
helado mediano con 4 de azúcar o un café caliente con 4 de azúcar. Él nota que el café helado nunca está tan
dulce como el caliente. ¿Por qué?
2. Andrea
quiere hacer caramelo duro. La receta
dice disolver 200 g de azúcar en 100 g de agua.
Andrea observa que hay aún azúcar sin disolver en el fondo de la sartén. Basándote en los conocimientos que tienes
acerca de la solubilidad, ¿qué puede hacer Andrea para asegurarse que todo el
azúcar se disuelva?
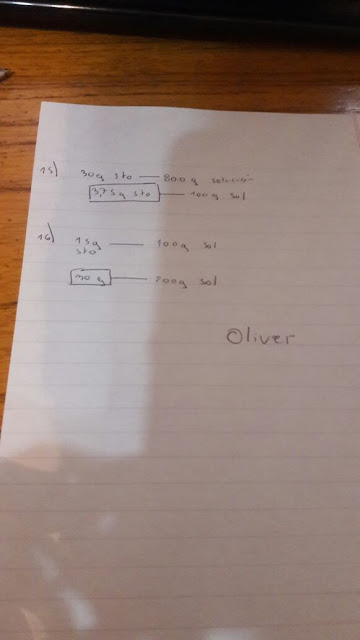
3. Una
acera común tiene 550 cm por 305 cm. Si
hay 5 cm de nieve en la acera, ¿cuál es la máxima cantidad de sal gruesa que
puede disolver el agua proveniente de la nieve?
La sal gruesa es NaCl. (Ayuda:
la densidad del agua es aproximadamente 1g/cm3 porque 1ml = 1 cm3. ¿Es esto exacto? No, pero es lo suficientemente cercano para
los propósitos de este problema.)
Respuestas:
1
Tabla 1 Datos de la solubilidad:
1.
La tabla nos muestra
la cantidad de solubilidad que hay en el agua dependiendo de su temperatura.
2.
La relación es que mientras mayor sea la temperatura del agua
más será la cantidad de solubilidad posible.
3.
El soluto se disolverá por completo.
4.
Esta será una solución diluida.
5.
La cantidad máxima de soluto que podrá ser diluido a los 20ºC
es de 35 g.
6.
En este caso la solución será saturada.
7.
El soluto extra no se disolverá y quedara en el fondo del
recipiente.
8.
No se formara una solución, si no un sistema heterogéneo.
Ejercicios:
1.
El soluto de mi grafico
es NH4Cl (cloruro de amonio).
2.
La sustancia es NaNO3
(nitrato de sodio).
3.
La sustancia es SO2 (dióxido de azufre).
4.
La diferencia es que la
curva de NH3 va de mayor soluto en menor temperatura, a menor soluto en mayor
temperatura. La curva de NaNO3 es al revés de menor soluto en menor
temperatura, a mayor soluto en mayor temperatura.
5.
SOLIDO
|
GAS
|
Kl (yoduro de potasio)
|
SO2 (dióxido de
azufre)
|
NaNO3 (nitrato de sodio)
|
NH3 (amoniaco)
|
KNO3 (nitrato de potasio)
|
HCl (cloruro de
hidrogeno)
|
NH4Cl (cloruro de amonio)
|
|
KCl (cloruro de potasio)
|
|
NaCl (cloruro de sodio)
|
|
KClO3 (clorato de potasio)
|
|
6. Al aumentar la temperatura, se
incrementa la energía de movimiento de las partículas de soluto y solvente, por
esto las fuerzas intermoleculares se debilitan. Favoreciendo la mezcla entre
las partículas de los solutos sólidos y solventes. Pero en el caso de un soluto
gaseoso la disminución de fuerzas intermoleculares libera a las moléculas de
gas de las fuerzas que las mantienen en solución y escaparán del recipiente, se
observará que al aumentar la temperatura, disminuye la solubilidad de un gas en
un solvente.
Problemas:
1. Esto ocurre ya que el azúcar como
soluto solido a temperaturas altas se disuelve más rápido y se mezcla con la
leche y el café, en cambio si es un café helado tardara más tiempo.
2. Andrea debe calentar, el sistema
heterogéneo que le quedo entre el azúcar y el agua, hasta que no quede más
azúcar sin disolver. Luego enfriarlo y seguir con los pasos necesarios.
3. --------
Suscribirse a:
Entradas (Atom)